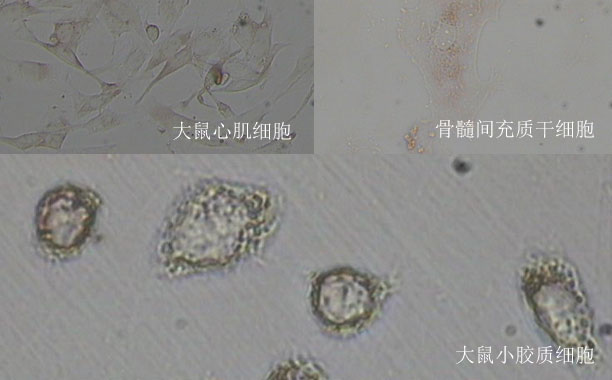
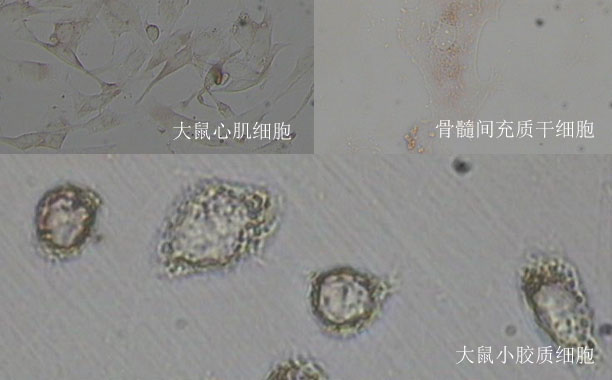
膜蛋白的跨膜區通常較為疏水,而研究人員通過生物信息學的分析發現,約有40%的單跨膜蛋白的跨膜區存在堿性氨基酸,其中包括廣泛表達的整合素家族,而這些堿性氨基酸主要分布在靠近富含酸性磷脂的質膜內側的位置。之前針對整合素aIIbb3的研究表明,跨膜區堿性氨基酸的突變會引起整合素的活化,但具體機制尚不清楚。
研究人員通過NMR,分子動態模擬和細胞生物學方法研究T細胞中重要的整合素aLb2發現,突變跨膜區堿性氨基酸K702后,會引起跨膜區二聚體的不穩定。分子動態模擬結果顯示,酸性磷脂可以同時與b2亞基上的K702位點以及aL上的R1094位點相互作用,從而穩定跨膜區異源二聚體。在生理狀態下,這一作用可以調控整合素aLb2胞外段的構象以及對配體ICAM-1的親和力。
TCR活化后,胞外鈣離子快速內流,引起胞內鈣離子濃度升高,內流的Ca2+可以通過與酸性磷脂結合,引起aLb2跨膜區的分離以及整合素的活化。該項研究提出了膜內靜電相互作用在調控受體構象及活性中的重要作用,同時提出了Ca2+內流調控aLb2活性的新機制。由于堿性氨基酸在跨膜區中廣泛存在,這一蛋白-磷脂靜電相互作用調控膜蛋白結構與功能的機制可能具有廣泛的適用性。
研究組一直從事脂質分子調控T細胞重要受體結構及功能的研究,前期的研究發現細胞質膜內層酸性磷脂通過與TCR/CD3以及CD28胞內區堿性氨基酸簇發生靜電相互作用從而屏蔽TCR的活化以及CD28的下游信號,而T細胞初始激活產生的Ca2+可通過靜電競爭解除TCR和CD28的屏蔽并促進其活化,從而提高T細胞的抗原敏感性,放大T細胞信號強度。而該項研究發現跨膜區的堿性氨基酸也可以通過與質膜內側的酸性磷脂形成靜電相互作用,調控受體蛋白的結構和活化。
貴州吉創生物技術有限公司主營涉及生物技術、醫學生物、動物實驗、藥品研發及其相關的實驗耗材試劑、設備儀器、實驗化學品及實驗技術服務等相關業務。可承接免疫印跡實驗(western blot)、酶聯免疫實驗(ELISA)、聚合酶鏈式反應(PCR)、動物實驗、細胞培養實驗、細胞藥品篩查實驗(MTT)等各類型實驗項目。是目前貴州省范圍內首家獨立經營的,擁有專職技術團隊及獨立實驗室的生物技術服務類公司。公司團隊致力于打造貴州省較為完善生物實驗技術服務交流平臺。
![貴州吉創生物技術有限公司[官網]](/Public/Uploads/image/picture/160userid20180911_p1536645747.png)